Corrosie
Corrosie is een oppervlakte verschijnsel die voortkomt uit een agressief milieu en een veelvoorkomend probleem in verschillende industrieën, vooral op het gebied van metaal corrosie. Daarnaast is het corrodeer proces te beschrijven als een natuurlijk proces, waarbij corrosieve aantasting kan optreden door de interactie met agressieve milieus. Metaal corrosie is een bekend probleem, vooral in vochtige omgevingen. In dit artikel worden de volgende onderwerpen behandeld:
- Wat is corrosie?
- Corrosie reacties
- Corrosief
- Corrosieve stof
- Soorten corrosie
- Wist je dat
Wat is corrosie?
Wat is corosie? Het begrip verwijst naar de aantasting van materialen, meestal metalen, door chemische reacties met hun omgeving.
De definitie van corrosie is geciteerd van ‘Corrosion Education Manual’ van de Europese Federatie voor Corrosie: “Corrosie is de aantasting van een materiaal door reactie met de omgeving met een daardoor veroorzaakte achteruitgang van de eigenschappen [1]. Wanneer geen materiaal benoemd wordt betreft het meestal een metaal, zoals aluminium. Corrosie aluminium is een specifiek probleem dat extra aandacht vereist, vooral bij industriële toepassingen en constructies waar aluminium veel wordt gebruikt. Corrosie wordt gebruikt om het proces van corroderen aan te duiden en ook de ontstaande schade. Maar wat is corrosief precies? Dit heeft te maken met stoffen die een materiaal ernstig kunnen aantasten.
Corrosie is dus een oppervlakte verschijnsel die voortkomt uit een agressief milieu. Daarnaast is het corrodeer proces te beschrijven als een natuurlijk proces. Zuiver metaal wordt gewonnen uit erts waar de metalen in geoxideerde toestand zitten. Om de erts te zuiveren wordt veel energie toegevoegd, van nature is de geoxideerde fase van het metaal een energetisch gunstigere fase. Daarom zal het metaal als natuurlijk proces terug waarderen naar de geoxideerde fase.
Uiteindelijk is preventief handelen tegen corrosie van uiterst belang. Materiaal wat afgewaardeerd raakt door de gevolgen moet vervangen of hersteld worden. Dit heeft een economisch aspect en milieu. Daarom is het van belang het betreffende materiaal op de gepaste manier tegen corrosie te beschermen. Corrosie testen bieden zekerheid voor de beschermlaag keuze.
Corrosie reacties
Drie soorten reactie mechanismes veroorzaken corrosie voor metalen, deze worden hieronder genoemd gevold met een toelichting.
- Chemische reacties
Gassen met hoge tempraturen die reageren met een metaal waarbij een oxidelaag vormt.
2. Metaal fysische reacties
Metalen bestaan uit een metaalrooster, waterstof gas is zo klein dat deze kan diffunderen in de metaalroosters. Hogere concentraties waterstof die het metaal ophopen veroorzaken brosheid. Dit kan gebeuren bij galvaniseren, anodiseren waar waterstof vormt in de elektrochemische reacties.
3. Elektrochemische reacties
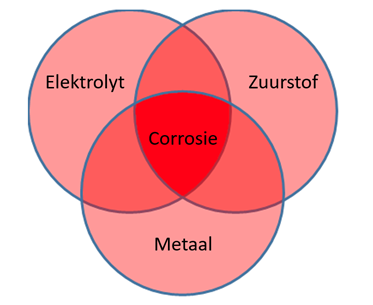
Deze vorm van reacties is het meest voorkomend in de natuur en is ook wel bekent als atmosferische corrosie. De reactie vind plaats onder drie voorwaarden: de aanwezigheid van een elektrolyt (water), zuurstof en een geleidend metaal (zie Figuur 2). Dit wordt ook wel elektrolytische corrosie genoemd. Als voorbeeld de half reacties van oxiderend ijzer:
Oxidatie/anodereactie Fe -> Fe2++ 2 e–
Reductie/kathode reactie O2+ 2 H2O + 4e– -> 4 OH–
Corrosief
Wat is corrosief? Deze term verwijst naar de eigenschap van bepaalde stoffen die materialen kunnen aantasten door chemische reacties.
Bij corrosie wordt gekeken naar het materiaal wat aangetast wordt, bij corrosief is het benaderingspunt de stof die schadelijk is voor het materiaal, ook wel bekend als een corrosieve stof. Aangebrachte schade door de corroderende stof zijn onherstelbaar. Het woord stamt af van het Latijnse corroderen, wat betekend bijten. Deze stoffen zijn ook gevaarlijk voor weefsels zoals de huid met als gevolg van de bijtende werking irritatie of zelfs brandwonden. Het GHS-symbool 05 waarschuwt voor de corroderende stoffen, Figuur 3. Daarnaast bestaat WMS-etikettering in een andere stijl met de zelfde pictogrammen. Vaak zijn het zuren of basische stoffen

Corrosieve stof
Corrosieve stoffen kunnen alle soorten fase zijn, solide, liquide en gas. Een stof wordt corrosief beoordeeld op zijn pH, deze gebieden liggen in zowel het zure als alkalische gebied (Figuur 4). Het is van uiterst belang voor de veiligheid om goed met de betreffende stoffen om te gaan, dus ook de opslag van de stoffen. Omdat de middelen zo uiteenlopen is het advies de Master Safety Data Sheet (MSDS) of chemiekaart van de stof na te gaan. Hier staan ook de H en P zinnen in, voor hazards (gevaren) en prevention (preventie).

Soorten corrosie
Verschillende soorten corrosie hebben diverse oorzaken en effecten op materialen, met ernstige economische en veiligheidsimplicaties.
- Oppervlakkige corrosie
Bij deze vorm wordt het oppervlak overal tegelijk gecorrodeerd. Dit komt door gehele blootstelling van het oppervlak aan atmosferische omstandigheden. Een voorbeeld hiervan is roest op staal.
2. Putcorrosie Putcorrosie, een gevaarlijk en lastig te detecteren vorm van corrosie, vereist continu aandacht vanwege de ernst van de schade die het kan veroorzaken aan metalen constructies.
Is een plaatselijke vorm van corrosie waar kleine gaatjes of putten tot gevolg zijn. Deze vorm van corrosie komt voor bij passieve metaal legeringen waar een klein deel van het passieve oppervlak doorbroken is. Chloride is een van de grootste boosdoeners voor het doorbreken van de passieve beschermlaag van metalen.
3. Spleetcorrosie
Het splijten of barsten van een metaal door corrosie die ontstaat bij materiaal waar een zuurstofrijk en zuurstofarm gebied is. De spleet waar het begint moet wijt genoeg zijn voor een elektrolyt om door te dringen tussen de spleet, daarnaast ook nauw genoeg om het elektrolyt daar vervolgens te houden.
4. Spanningscorrosie
Corrosie waarbij mechanische belasting van een vatbaar metaal omgeven is door een corrosief milieu. De gebieden waar de spanning gelokaliseerd is zullen als eerste corroderen, dit geeft duidelijke corrosie patronen.
5. Interkristalijne corrosie
Een bijzondere vorm van plaatselijke corrosie die zich volgt rondom de korrelgrenzen van een metaal. Bloodstelling van bijvoorbeeld roest vast staal aan hogere tempraturen gedurende langere tijd zal de homogene legering doen aanpassen. Hierdoor ontstaan er zwakkere gebieden waar corrosie zal doen optreden.
6. Galvanische corrosie
De corrosie vorm waarbij twee verschillende metalen aaneengrenzend zijn en een elektrisch geleidende verbinding vormen. Als hier een elektrolyt mee in aanmerking komt zal het minst edele metaal zich gedragen als anode en het edele metaal als kathode. Denk hierbij aan montage van galvanisch staal met roest vaste schroeven, hier zal het galvanische staal snel roesten.
Wist je dat
Het corroderen van ijzer heet roesten, andere metalen hebben voor het corroderen geen andere benaming.
Erosie is een proces waarbij een oppervlakte slijt. Een heel proces waaraan we heel veel mooie plekken op de aarde te danken hebben. Echter is dit proces ongewenst voor de bescherming van materiaal, naast corrosie heeft erosie bijvoorbeeld in pijpleidingen schadelijke gevolgen.
Roest Vast Staal (RVS), ook wel bekend als roest vrij staal komt aan zijn naam door de speciale samenstelling van de legering. Een gedeelte van de metalen in de legering oxideren aan het oppervlakte, roest vast, maar blijft des ondanks aan het oppervlakte in tegenstelling van het afbladeren van ijzer roest.


Volg ons op social media